慢病毒体外感染实验
(1)感染和分析
公司提供的慢病毒为VSVG 膜蛋白包裹的病毒。尽管与其他的膜蛋白相比, 它能够感染的细胞种类大大增加,但对不同的细胞和组织的亲嗜性仍有差别。
在使用三成山提供的慢病毒之前请查阅相关文献,了解这种慢病毒对目的细胞的亲嗜性,感染指数(MOI 值)以及体内(in vivo)注射所需的病毒量。如果没有相应文献的支持,则需要检测病毒对目的细胞的亲嗜性。实际上即使有文献支持, 但因为不同实验、细胞代数、细胞状态等的关系,细胞实际的MOI 值和文献报道的往往会有差异。
一般做正式实验前都需要安排预实验,以了解细胞所需 MOI 值以及病 毒对细胞状态的影响。
(2)慢病毒感染靶细胞预实验
2.1 慢病毒感染目的细胞预实验注意事项
① 测定慢病毒对目的细胞的亲嗜性时,需要同时设置对照慢病毒亲嗜性较 高的细胞(HEK293T, Hela)作为平行实验的对照细胞。
② 在进行慢病毒感染实验时,可以使用完全培养基(培养目的细胞用)稀 释:理论上,含有血清、双抗或者其他营养因子的完全培养基不影响慢病毒的感染 效率。
③ 一般慢病毒单位为TΜ/mL,即每毫升中含有具有生物活性的病毒颗粒 数。如:病毒滴度为>1 x 10 8TΜ/mL 即每毫升病毒液中至少含有 1 x 10 8 个具有生 物活性的慢病毒颗粒。
2.2 Polybrene 的选择 Polybrene 是带正电的小分子,与细胞表面的阴离子结合,提高慢病毒对细 胞的感染效率,通常加入Polybrene 能提高感染效率 2~10 倍。
Polybrene 有一定的细胞毒性,有的细胞对 Polybrene 的毒理反应明显,因此 细胞感染时是否适合Polybrene 需要摸索:不同细胞对Polybrene 的敏感度不同,可以用 1~10μg/mL 的范围筛选合适的浓度,以 24h 内细胞无明显毒性反应为佳, 可参考文献并进行预实验摸索,Polybrene 最常用的工作浓度为 6~8μg/mL。
注:1)公司提供的 Polybrene 产品,用户可用以进行辅助感染。Polybrene 母 液保存在-20℃(可稳定保存一年),避免反复冻融。
2)Polybrene 预实验请先以对照病毒进行摸索,部分细胞系MOI 及 Polybrene 的使用见附录。
2.3 感染细胞最佳 MOI 的测定 若无相关文献支持,需要通过预实验确定合适的感染复数(MOI 值)。MOI (Mμltiplicity of Infection,感染复数)是指每个细胞感染的病毒数,通常MOI 越高,病毒整合到染色体的数量以及目的蛋白的表达量越高。对于分裂活跃的细胞, 比如 Hela、293 细胞,MOI=1 时,80%以上的细胞均表达目的基因。而对于非分 裂细胞,比如原代细胞,感染效率较低。我们建议通过比较不同MOI(比如 0、 1、5、10、50、100 等),选择适合的 MOI 进行实验(可以考虑选用携带报告 基因的病毒,比如Lenti-eGFP)。
以 96 孔培养板为例,进行目的细胞和对照组细胞的感染预实验,实验前按照不同的MOI 设置不同的感染孔,并根据MOI 和细胞数量计算所需的病毒量。
第一天,目的细胞和平行对照组细胞(对慢病毒亲嗜性较高的细胞如 293T,Hela)以 5×10 3 个/孔接种于 96 孔板中,每孔培养基的体积为 100μL,细胞数以 第二天密度约 30%~50%为宜,37℃培养过夜。
第二天,感染前,从-80℃冰箱取出后在冰浴融化病毒,用含 5μg/mL Polybrene 的新鲜培养基按不同的MOI 值稀释病毒原液(Polybrene 在大部分细胞中可以有 效提高感染效率)。准备 3 个无菌的 EP 管,先加入 90μL 新鲜培养基,吸取 10μL 的 1×10 8TΜ/mL 的病毒原液加入到第一管中,轻柔混匀,勿产生气泡。从第一 管中吸取 10μL 加入到第二管中,混匀后,吸取 10μL 加入到第三管中,混匀, 这样就得到三个不同梯度的病毒液:原液,10 倍稀释,100 倍稀释,对应的 MOI 值分别为 100,10,1。还可以根据实际实验需要设计更多的MOI 值。 吸去培养器皿中的培养基 90μL,在目的细胞和对照细胞中分别加入不同 MOI 值得病毒液 90μL。混匀后放于二氧化碳培养箱(37℃,5% CO2)孵育过夜。 注:感染前细胞的状态好坏对最终的感染效果高低影响很大,所以务必保证 加病毒之前细胞处于良好的生长状态。慢病毒对目的细胞的感染效率较低时,通 过提高 MOI 值可以提高病毒的感染效率,但是当MOI 值高于 20 时,我们建议 在培养基中加入Polybrene(具体浓度因不同的细胞而异,具体的请参考相关文 献)来提高病毒的感染效率。
第三天,更换培养液:一般在 24~48 小时后将含有慢病毒的培养液更换成 正常培养液:感染后观察细胞状态,如果慢病毒对细胞有明显毒性作用而影响细胞 生长状态,可以最短在加病毒 12~24 小时更换新鲜培养液后继续培养,第一次换 液后,如果慢病毒对细胞没有明显毒性作用,按照正常培养条件培养换液。
第六天,感染效率检测:在倒置荧光显微镜观察荧光,估计慢病毒感染目的细 胞的效率,最后确定合适的MOI 值。
(3)慢病毒感染靶细胞正式实验
通过细胞预实验可以大致知道使用慢病毒感染目的细胞的优化条件,例如需不需要添加Polybrene,MOI 值是多少?正式实验时所用的细胞数往往比预实验的多,这就会存在一个计算病毒用量的问题。放大的原则是保持病毒的浓度不变。假 设预实验得到的细胞的MOI 值为 10,96 孔板培养基为 100μL,用了 1×10 8 TΜ/mL 病毒 1μL,我们需要感染的是 6 孔板,感染时所用的体积是 2mL,那么保 持病毒浓度不变,所需病毒就应为 1×10 8 TΜ/mL 病毒 20μ L.(注意:细胞的种板 密度跟最终的感染效果很有关系,通常感染细胞的聚合度为 20~30%。遇到生长较 快或慢的细胞,聚合度应适当降低或增加,以使得感染后的细胞 3 天培养至 80%以上 密度为宜。)
慢病毒载体是一个接近 100nm 大小的颗粒,在溶液上层中的病毒颗粒很少有机会接近细胞。感染时减少培养基的体积能提高病毒的感染效率。通常我们在感 染 6 孔板时将培养基体积减少到 1mL,即当细胞的 MOI 值为 10 时,加入 20μL的 1×10 8 TΜ/mL 病毒。同样,12 孔板时体积减少到 500μL、24 孔板减少到 300μL。 (不同孔板的病毒用量见表 1)由于存在不完全成比例的放大,再加上细胞状态, 细胞聚合度不同,病毒滴度和真实值之间会有差异,所以如果需要用大量的病毒感 染细胞之前,还可以在选择 24 孔板再尝试一次感染。假设细胞的MOI=10, A. 根据细胞的量将细胞在 1.5mL EP 管中离心收集然后用 100~200μL 的无血清培养液稀释细胞沉淀,以细胞完全浸没在培养基中为准。 病毒滴度时 1×10 8 TΜ/mL,细胞聚合度为 20~30%,病毒用量可设计为 25μL, 5μL,10μL,感染体积 500μL,进一步筛选出更加优化的感染条件。
1×10 8 TΜ/mLTΜ/mL 病毒感染细胞所用培养基体积和病毒量参考:
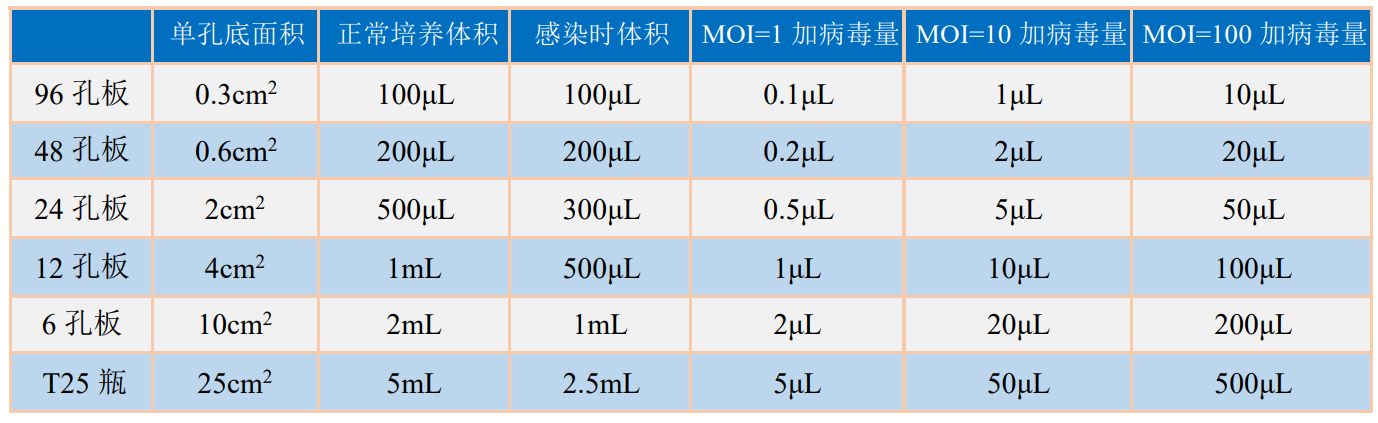
感染方法
A. 按实验需要将细胞铺板(比如 6 孔板)。细胞数以第 2 天密度约 50%为宜。 37℃ 培养过夜。
B. 感染前,从-80℃冰箱取出后在冰浴融化病毒,参考相关文献或者根据预实验 得到的 MOI 值用新鲜完全培养基稀释成所需浓度。注意:轻轻混匀,不要使用 振荡器。
C. 吸去细胞原有培养基,将按照MOI 稀释好的病毒液加入细胞中。
D. 加入 Polybrene(对于 293 细胞,终浓度 6μg/ml),轻轻摇匀。37℃培养过夜。 注:Polybrene 可以和病毒原液一起加到培养基中:慢病毒对目的细胞感染效率较 低时,可以通过提高MOI 值来提高感染效率,但是当MOI 高于 20 时,我们建 议客户添加Polybrene(终浓度 2~12μg/ml,浓度因不同的细胞而异,具体的请 参考相关文献)来提高病毒的感染效率。如果感染目的细胞是 Jμrkat,kasμmi, NB4,H929,GBC-SD,MCF-7 等,建议不要添加Polybrene;大部分原代细胞 感染也不需要添加Polybrene,以上仅供参考,具体详见附录。
E. 感染 24 小时后,吸除含慢病毒的培养基,换为新鲜的培养基。
F. 继续培养 48-72 小时后,根据需要收集细胞检测目的蛋白的表达。
悬浮细胞的感染方法
A. 根据细胞的量将细胞在 1.5mL EP 管中离心收集然后用 100~200μL 的无血 清培养液稀释细胞沉淀,以细胞完全浸没在培养基中为准。
B. 按照 MOI 换算病毒颗粒数量,吸取病毒液加入细胞中,将 1.5mL EP 管放 在 37℃ 培养箱中孵育 30 分钟。
C. 将管中混合溶液吸出加到培养皿中或孔里。
D. 加入足够量的新鲜培养液。
E. 12 小时后换液。
F. 96 小时后观察细胞阳性率。